Биохимия зрения и свободно-радикальное окисление
Искажённая до неузнаваемости статья ФОТОБИОЛОГИЧЕСКИЙ ПАРАДОКС ЗРЕНИЯ, М. А. Островского, Института биохимической физики РАН им. Н. М. Эмануэля, Москва М.А. Островский ФОТОБИОЛОГИЧЕСКИЙ ПАРАДОКС ЗРЕНИЯ
Свободно-радикальное фотоокисление — прямая реакция взаимодействия активированного сенсибилизатора c компонентами клетки, так и образование сначала активных форм кислорода, которые, в свою очередь, взаимодействуют и повреждают ее нуклеиновые кислоты, белки и липиды.
Недавно было показано, как высокотоксичный синглетный кислород, образующийся при облучении А2Е (в англоязычной литературе pyridinium bisretinoid или сокращенно А2Е) синим светом, повреждает не только биохимические компоненты клетки, но атакует и сами молекулы А2Е, превращая их в еще более токсичную эпоксидную форму — бис-ретиналиден-фосфатидилэтаноламин (А2Е-РЕ).[1].
Исследования фототоксичности липофусциновых гранул и их флуорофоров, особенно А2Е, активно продолжается. Цель этих работ — подробное выяснение их роли в патогенезе ряда дегенеративных и других заболеваний сетчатки.
ВведениеПравить
Зрительные фотопигменты опсины в сетчатке позвоночных в фоторецепторах колбочках и палочках (например, родопсин в палочках) — это сложные молекулы, которые представляет собой хромогликопротеиды, содержащие одну хромофорную группу, две олиго-сахаридные цепочки и водонерастворимый мембранный белок опсин. Родопсин является первым мембранным белком животного происхождения, полная аминокислотная последовательность которого была расшифрована в начале 80-х годов Овчинниковым и сотрудниками, Харгрэйвом и сотрудниками (Овчинников и др., 1982, Hargrave et al., 1982). Сравнительно недавно удалось кристаллизовать родопсин, а методом рентгено-структурного анализа в начале с разрешением в 2,8Å, а позже с разрешением в 2,2Å получить его трехмерную структуру (Palczewskiet al., 2000; Liang et al., 2003; Okada et al., 2004)
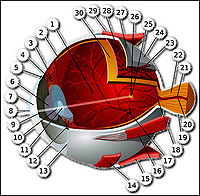
В сетчатке позвоночных родопсин содержится в фоторецепторах ночного и сумеречного зрения – палочках (рис. 1).
Благодаря приведенным данным в литературе подробно описан хромофорный центр родопсина: конформационное состояние 11-цисретиналя и его взаимодействие с окружающими аминокислотными остатками.
Хромофорной группой всех без исключения зрительных фотопигментов человека и животных является альдегид витамина А1 или витамина А2 или, соответственно, ретиналь1 или ретиналь2, причем только одна из его изомерных форм, а именно его 11-цис-форма. Родопсин – сравнительно небольшой белок: молекулярная масса которого составляет около 40 кДа, а полипептидная цепь состоит из 348 аминокислотных остатков. В молекуле родопсина можно выделить внутримембранный, внутридисковый и цитоплазматический домены. Внутримембранный домен состоит из хромофорного центра и семи трансмембранных α-спиралей, представляющих собой остов опсина. Хромофорная группа – 11-цис-ретиналь ковалентно связан с ε-аминогруппой лизина (Lys-296) спирали ТМ7 через протонированное Шиффово основание. Протонирование Шиффова основания увеличивает делокализацию электрона вдоль полиеновой цепи ретиналя.
Спектр поглощения родопсина состоит из трех основных полос:
- α- 498 нм,
- β- 350 нм,
- γ- 280 нм (рис.3).
Две первые связаны с поглощением хромофорной группы, а γ-полоса обусловлена в основном поглощением ароматических аминокислот белка – триптофана, тирозина и фенилаланина.
Именно α- полоса в спектре поглощения родопсина определяет кривую видности палочкового сумеречного (скотопического) зрения с максимумом в сине-зеленой области спектра (≈500 нм). Фоточувствительность родопсина необычайно высока. Квантовый выход фотореакции составляет 0,67.
Фотопревращение или фотолиз фотопигментов, например, родопсина включает собственно фотохимическую реакцию и последующие темновые, зависящие от температуры, превращения. Схема фотолиза молекулы родопсина показана на рис. 4. Единственной фотохимической реакцией зрения является цистранс изомеризация хромофорной группы – 11-цис-ретиналя. Эта реакция происходит с необычайно высокой скоростью – менее чем за 200 фемтосекуды (200x10−15секунды). За это время образуется первый фотопродукт – фотородопсин, в котором 11-цис-ретиналь уже перешел в полностью-транс форму, но продолжает быть ковалентно связанным с белком.
До сих пор остаётся неясным, почему скорость фотоизомеризации ретиналя как хромофора увеличивается почти на два порядка по сравнению со скоростью его фотоизомеризации в растворе. В любом случае роль белкового окружения в этих процессах находится вне сомнения, но внутримолекулярные механизмы, объясняющие этот феномен, остаются до конца не изученными.
Т.о. цветное зрение, связанное с восприятием цвета, зависит от способности фоторецептора сетчатки воспринимать определённые спектральные лучи благодаря локализации в их мемранных слоях органических фотопигментов группы опсинов,которые состоят из хромоформной группы 11-цис-ретиналя и которые под действием определённых лучей света претерпевает фотохимическую реакцию с фотопревращениями или фотолизом. Процесс фотопревращения (фотолиза) родопсина завершается разрывом ковалентной химической связи полностью-транс ретиналя с белком. В итоге ретиналь высвобождается из белка и оказывается в фосфолипидном окружении фоторецепторной мембраны. Т.е. получив энергию фотонов луча света фотопигмент родопсин распадается с одновременной выдачей биологического сигнала поглощённого луча света для дальнейшего оппонентного отбора на нейронном уровне для выдачи в мозг, с последующим восстановлением.
Схема механизма фототрансдукцииПравить
Механизм фототрансдукции (преобразование и передача первичного светового сигнала (не цветового)) обеспечивает преобразование и усиление первичного светового сигнала почти в миллион раз в клетке фоторецептора. Упрощенная схема процесса фототрансдукции представляется на схеме (рис. 1).
Квант света поглощается хромофорной группой молекулы родопсина «Р» – 11-цис ретиналем и изомеризует её в полностью-транс форму. Данная реакция происходит менее, чем за 200 фемтосекунд. Это первая и единственная фотохимическая реакция в зрении. Цис-транс переход ретиналя вызывает, в свою очередь, конформационную перестройку белковой части молекулы (опсина): сначала ближайшего к хромофору окружения, а затем и всей белковой части. Вследствие этого родопсин приобретает способность к взаимодействию со следующим белком в цепи процессов фототрансдукции – G-белком (в зрительной клетке он называется трансдуцином (Т). Активированный трансдуцин, в свою очередь, активирует следующий белок – фермент фосфодиэстеразу (ФДЭ). Этот фермент с высокой скоростью гидролизует низкомолекулярный внутриклеточный передатчик – циклический гуанозинмонофосфат (цГМФ). Падение в цитоплазме наружного сегмента клетки фоторецептора концентрации свободного цГМФ приводит к гиперполяризации клеточной мембраны. Этот электрический потенциал, собственно, и представляет собой фоторецепторный сигнал, который передается в первом синапсе сетчатки следующим нервным клеткам – биполярным и горизонтальным. Таким образом, цепочка процессов родопсин – трансдуцин – фосфодиэстераза представляет собой каскад ферментативных реакций, обеспечивающих трансформацию, усиление светового сигнала в 105–106 раз.
Активация родопсина в ходе его фотолиза является первым этапом каскада фототрансдукции. Активированным фотопродуктом родопсина является метародопсин II, который и активирует G-белок зрительной клетки, т.н. трансдуцин. Фотолиз и передача первичного сигнала в системе клеток фоторецепторов сетчатки глаза по нервным клеткам биполярным и горизонтальным напоминает передачу света в волноводах, но с тем отличием, что сигнал трансфрмируерся c увеличением в сотни раз, при этом главное при фокусировании предметных точек на фокальную поверхность сетчатки, чтобы фокусировка происходила в зоне ганглиозных клеток фоторецепторов ipRGC с величиной кружков нерезкости диаметром 7-9 мкм (острота зрения=1-0,8), где происходит первая встреча с точками первичного оптического изображения (не цветное).
В разное время в ходе развития представлений о механизмах трансдукции фоторецепторного сигнала в качестве медиатора рассматривались ионы кальция [15] и циклический гуанозинмонофосфат [30]. Начиная с 1985 г. после работ Фесенко с соавт. [21] ни у кого не вызывает сомнения, что ионная проницаемость плазматической мембраны наружного сегмента фоторецептора контролируется не ионами кальция, а цГМФ, который поддерживает в темноте ее ионные каналы в открытом состоянии.[5]
Цикломононуклеотидная гипотеза. Согласно цикломононуклеотидной гипотезе, основную роль в передаче сигнала от диска к плазматической мембране играет цГМФ [21]. Рассматривать цГМФ как основной химический посредник в фототрансдукции позволяют следующие факты:
- фоторецепторная клетка значительно обогащена цГМФ (темновой уровень свободного цГМФ составляет 4 мкМ). По сравнению с тканью головного мозга содержание цГМФ в сетчатке на два порядка выше [58].
- фоторецепторная клетка содержит ферменты метаболизма цГМФ, с помощью которых осуществляется синтез и гидролиз цикломононуклеотида гуанилатциклазу и фосфодиэстеразу (ФДЭ).
- уровень содержания цГМФ в НСП контролируется светом, поглощенным родопсином. Показано, что в расчете на один поглощенный фотон гидролизуется 4% цГМФ [46].
- цГМФ обладает электрофизиологической активностью. Он вызывает увеличение проницаемости плазматической мембраны для Na+ (цГМФ-индуцированная проводимость) и следующую за этим ее деполяризацию [47].
В фоторецепторной клетке функционирует зависимая от света система ферментативных реакций, с помощью которых осуществляется гидролиз цГМФ (так называемый "цГМФ каскад", схема которого представлена на рис. 2). В нем участвуют следующие белки: 1) ГТФ-связывающий белок (трансдуцин), состоящий из 3-х субъединиц Тa (39 кДа), Тb (36 кДа), Тg (6-7 кДа) [62]; 2) фосфодиэстераза цГМФ, состоящая из 4-х субъединиц (a b g 2) [44]; 3) родопсинкиназа (68 кДа) [54]; 4) белок с молекулярной массой 48 кДа, получивший название арестина [54]; 5) рековерин (26 кДа), ингибирующий фосфорилирование родопсина [14].
Биохимические события в клетке, запускаемые поглощением кванта света можно представить в следующем виде: фотовозбужденный родопсин (Р0*) после ряда последовательных темновых превращений на стадии перехода в метародопсин II приобретает способность (посредством латеральной диффузии и столкновений) связываться с ГТФ-связывающим белком НСП трансдуцином (Т). Это взаимодействие сопровождается диссоциацией субъединиц трансдуцина на два компонента Тa и Тb g и обменом ГДФ на ГТФ на a-субъединице. Образовавшийся комплекс Тa × ГТФ диффундирует в цитоплазму, где взаимодействует с фосфодиэстеразой с образованием комплекса Тa × ГТФ× ФДЭ. При этом происходит активация ФДЭ за счет отделения от фермента белкового ингибитора, впервые обнаруженного Думлер и Этингоф [16], и переход ФДЭ из свободного в мембраносвязанное состояние. Активированная фосфодиэстераза с высокой скоростью (Л.А. Баранова, В.П. Емельянова, И.Д. Волотовский Молекулярные механизмы зрения (обзор литературы))
(О зрительном цикле и опасности фотоповреждения смотри ниже).
Зрительный цикл и опасность фотоповрежденияПравить
Основные факторы протекания зрительного цикла в настоящее время представляются следующим образом (см. Saari, 2001, Sun, Molday, Nathans, 1999, Sun, Nathans, 2001). Схематически они представлены на рис. 6А.
Как уже говорилось, после отщепления от белковой части (Опсины|опсина) и высвобождения из молекулы зрительного пигмента транс-ретиналь необходимо его как можно скорее удалить из фоторецепторной мембраны диска. Недавно выяснилось, что ключевую роль в его активном транспорте из мембраны играет специальный белок – т.н. АТФ — связывающий кассетный переносчик ретиналя (ATP-binding cassette transporter или сокращенно ABCR). Этот относительно большой мембранный белок расположен в краевой «петле» диска, где это положение связано c затратой энергии АТФ и где он активно переносит свободный трансретиналь через фоторецепторную мембрану в цитоплазму наружного сегмента (Sun, Molday, Nathans, 1999). При этом, скорее всего, он переносится через мембрану в комплексе с фосфатидилэтаноламином (одним из трех основных фосфолипидов фоторецепторной мембраны). Затем, будучи уже в цитоплазматическом пространстве наружного сегмента, с помощью фермента ретинол-дегидрогеназы транс-ретиналь превращается в транс-ретинол или витамин А, который переносится из фоторецепторной клетки в субретинальное межклеточное пространство. Здесь он связывается со следующим белком зрительного цикла – т.н. межфоторецепторным ретинол-связывающим белком (interphotoreceptor retinoid-binding protein, IRBP), и с его помощью переносится в клетку пигментного эпителия.
Наследственные или благоприобретенные дефекты любого из участников зрительного цикла способны привести к его нарушению. В настоящее время накапливается все больше информации о том, что мутация гена, кодирующего синтез одного из ключевых элементов зрительного цикла — синтез белка ABCR, ответственна за избыточное накопление в пигментном эпителии липофусциновых гранул (рис. 6Б) и за возникновение и развитие болезни Штаргарда (Allikmets, Singh, Sun et al., 1997). Подобные изменения этого же ABCR-гена обнаружены и у пациентов, страдающих старческой макулярной дегенерацией сетчатки (Allikmets, Shroyer, Singh et al., 1997).
А) Механизм активного удаления полностью-транс ретиналя из фоторецепторной мембраны диска после фотолиза родопсина (подробности в тексте).
Б) Накопление в клетках пигментного эпителия липофусциновых гранул, вызванное наследственным дефектом белка ABCR или его фотосенсибилизированным ретиналем окислением (повреждением)[6]
Связь дефекта белка ABCR с развитием ряда форм дегенерации сетчатки можно представить следующим образом. В силу невозможности нормального, достаточно быстрого удаления ретиналя из фоторецепторной мембраны диска приводит к его накоплению в этой мембране, что представляет опасность в силу его фототоксичности (см. ниже), и затем к его химическому взаимодействию с одним из трех основных фосфолипидов в этой мембране – с фосфатидилэтаноламином. Ситуация при этом усугубляется тем, что с одной молекулой фосфатидилэтаноламина взаимодействуют сначала одна, а потом и вторая молекула транс-ретиналя. В результате в мембране образуется т.н. бис-ретиналиден-фосфатидилэтаноламин (А2Е- РЕ). Исходя из всего, он и сам по себе фототоксичен. Главное же – он служит предшественником следующего крайне фототоксичного соединения – бис-ретинилиден-этаноламина (в англоязычной литературе pyridinium bisretinoid или сокращенно А2Е) (рис. 5 – А2Е является основным флуо- рофором липофусциновых гранул, и в них обнаруживается более десятка флуорофоров). Откуда липофусциновые гранулы сильно флуоресцируют. В культуре ткани пигментного эпителия А2Е способен проявлять себя как детергентные свойства, повреждая, например, наружную митохондриальную мембрану и запуская апоптоз клетки (Suter et al, 2000), так и выступать в качестве фотосенсибилизатора свободно-радикального повреждения клетки, что в итоге также способно вызвать ее апоптоз. Механизм образования А2Е до конца не выяснен. Например, твердо не установлено, где именно происходит образование А2Е из А2Е-РЕ — либо в клетке пигментного эпителия в фаголизосоме (фаголизосома – это слившаяся с лизосомой фагосома; фагосома – это фагоцитированный пигментным эпителием обломок наружного сегмента фоторецептора), либо – в наружном сегменте, в самой фоторецепторной мембране, и затем уже в составе обломка наружного сегмента попадает в пигментный эпителий. Согласно современным представлениям избыточное накопление липофусциновых гранул и А2Е в пигментном эпителии связано с дегенеративными изменениями сетчатки, а также с усугубляющим действием EA и синего света при различных формах дегенерации (Fine, Berger, Maguire et al., 2000). Механизм этой связи в настоящее время интенсивно изучается.
Молекулярные механизмы фотоповрежденияПравить
Главным образом можно выделить два класса фотоповреждений.
- Первый класс — когда речь идет о сравнительно низких интенсивностях света , при этом о его длительном действии (от дней до недель), где повреждаются в основном фоторецепторы.
- Второй класс – с гораздо более высокими световыми интенсивностями и облучении от секунд до часов.
В данном класе — в первую очередь повреждаются клетки пигментного эпителия, а затем сетчатки.
Максимум спектра действия для первого класса фотоповреждений соответствует спектру поглощения родопсина, т.е. наиболее эффективна синезеленая область видимого спектра, для второго — спектр действия находится в УФ- и синей областях спектра (см: Островский, Федорович, 1987; Kremers, van Norren,1988).
Для человека и дневных животных гораздо большую опасность представляет слишком яркий свет в ультрафиолетовой и синей областях спектра.
Механизмы указанных поврежденийПравить
Механизмы повреждений, в основе которых лежат фотохимические реакции сенсибилизированного свободнорадикального окисления, определяется тремя факторами:
- Наличие поглощающих свет фотосенсибилизаторов,
- Субстратов окисления,
- Присутствие кислорода.
Как уже говорилось, в сетчатке и в пигментном эпителии все три фактора присутствуют в полной мере. Фотосенсибилизаторами могут служить как эндогенные, так и экзогенные окрашенные соединения. К эндогенным фотосенсибилизаторам Фотобиологический парадокс зрения 143 сетчатки и пигментного эпителия в первую очередь относятся ретиналь и продукты его превращения.
Рассмотрение начинается с липофусциновых гранул и их основного флуорофора — бис-ретинилиден-этаноламина (А2Е) (рис. 7).
Ранее считалось, что липофусциновые гранулы являются безвред- ным балластом, накапливающимся в постмитотических клетках по мере старения организма. Однако оказалось, что они фототоксичны, поскольку обладают способностью генерировать при действии света активные формы кислорода – синглетный кислород и его супероксидные радикалы (Островский, Донцов, Сакина и др., 1992; Boulton , Dontsov, Ostrovsky et al., 1992; Boulton , Dontsov, Ostrovsky et al., 1993; Wassel et al., 1999; Rozanowska et al., 1999). Спектры действия генерации этих активных форм кислорода от длины волны облучения указывают на то, что УФ- и синий свет действуют гораздо эффективнее (опаснее), нежели зеленый и красный. На рис.8 показана зависимость накопления суперокисных анион-радикалов кислорода от длины волны облучения суспензии липофусциновых гранул, выделенных из пигментного эпителия донорских глаз человека (Boulton , Dontsov, Ostrovsky et al., 1993). Давно описанная опасность повреждающего действия синего света на сетчатку и пигментный эпителий (Ham, Ruffolo, Mueller et al., 1978) скорее всего связана с фототоксичностью липофусциновых гранул. Выступая в роли сенсибилизаторов фотоокисления, липофусциновые гранулы способны стимулировать окисление липидов и кардиолипиновых липосом, белков (инактивацию их ферментативной актив- ности), повреждать биологические мембраны (Dontsov, Glickman, Ostrovsky 1999; Wassel, Davis, Bardesley et al. 1999). Согласно предварительным данным, липофусциновые гранулы способны при их облучении синим светом вызывать апоптоз клетки пигментного эпителия, то есть ее запрограммированную гибель. Облучение же в культуре ткани клеток пигментного эпителия, нагруженных флуорофором липофусцина – А2Е, неизбежно приводит к их апоптозу (Sparrow, Nakanishi, Paris, 2000). Следует отметить, что апоптоз рассматривается сейчас как общий конечный путь гибели клеток при многих заболеваниях сетчатки, включая различные формы дегенерации и дистрофии. Механизм свободно-радикального фотоокисления включает как прямую реакцию взаимодействия активированного сенсибилизатора с компонентами клетки, так и образование сначала активных форм кислорода, которые в свою очередь взаимодействуют и повреждают ее нуклеиновые кислоты, белки и липиды. Недавно было показано, как высокотоксичный синглетный кислород, образующийся при облучении А2Е си- ним светом, повреждает не только биохимические компоненты клетки, но атакует и сами молекулы А2Е, превращая их в еще более токсичную эпоксидную форму (Sparrow Zhou, Ben-Shabat et al., 2002; Ben-Shabat, Itagaki, Jockusch et al., 2002). Исследования фототоксичности липофусциновых гранул и их флуорофоров, особенно А2Е, активно продолжается. Цель этих работ — подробное выяснение их роли в патогенезе ряда дегенеративных заболеваний сетчатки.
Фототоксичность ретиналяПравить
Ретиналь – хромофор в молекуле зрительного пигмента и предшественник А2Е – флуорофора липофусциновых гранул. Он представляет собой один из эффективных природных сенсибилизаторов. Как видно из таблицы 1, его фотосенсибилизирующая активность лишь вдвое ниже, чем у такого классического сенсибилизатора, как рибофлавин (Сапежинский, 1988). Как говорилось выше, конечным продуктом обесцвечивания родопсина (λмакс.=500нм) является метародопсин II (λмакс.=380 нм) или уже высвободившийся полностью-транс ретиналь (λмакс.=380 нм). В своё время было показано, что при действии света на обесцвеченные фоторецепторные мембраны, содержащие метародопсин II или трансретиналь, наблюдается фотоокисление и белковой части родопсина (SH-групп опсина), и липидов фоторецепторной мембраны (Погожева, Федорович, Островский и др. 1981). В этой же работе был определен спектр действия, т.е. зависимость окисления белков и липидов этой мембраны от длины волны облучающего света. Оказалось, что их фотоокисление наиболее выражено в области 380 нм, то есть в той же области, что и спектр поглощения свободного ретиналя (или метародопсина II). Следствием этого являются необратимая агрегация молекул родопсина в фоторецепторной мембране, уменьшение способности родопсина к регенерации при добавлении извне 11-цис-ретиналя, т. е. нарушение его нативных свойств.
Субстраты фотоокисленияПравить
Молекулярные компоненты фоторецепторной мембраны – белки, например, (родопсин) и липиды — представляют собой идеальные субстраты для реакции фотосенсибилизированного окисления. Тремя основными фосфолипидами мембраны фоторецепторов колбочек, палочек являются фосфатидилхолин, фосфатидилэтаноламин и фосфатидилсерин. Состав этих фосфолипидов уникален и содержит: более 60% полиненасыщенных жирных кислот, при этом на долю длинноцепочечной, т.н. докозагексаеновой кислоты, которая содножит 22 углеродных атома и 6 двойных связей (С22:6), приходится около 75% всех жирных кислот (см. Островский, Говардовский, 1992). Благодаря этому мембрана фоторецептьров обладает исключительно низкой вязкостью, сравнимая с оливковым маслом и равной примерно двум пуазам. Такая малая вязкость позволяет, одной из равновидностей опсинов — родопсину и другим белкам этой мембраны претерпевать быструю вращательную и более медленную латеральную диффузию.
Фотоокисление белков и липидов мембраны фоторецепторов происходит параллельно и практически независимо. Так, добавление известного ингибитора перекисного окисления липидов – 2,6-ди-трет-бутилокситолуола (дибунола) полностью предотвращает фотоокисление липидов в мембране родопсина и лишь частично снижает скорость окисления тиоловых групп белка (Погожева, Федорович, Островский и др. 1981).
Следствием фотоокисления родопсина и липидов в фоторецеп- торной мембране являются:
- образование внутри- и межмолекулярных дисульфидных связей
(«сшивок»);
- образование необратимых белковых агрегатов, подвижность ко-
торых в мембране крайне низка;
- потеря способности окисленного и агрегированного родопсина к регенерации как in vitro, так и in vivo (Погожева, Кузнецов, Лившиц и др., 1981; Погожева, Кузнецов В.А., Федорович и др., 1981; Островский, Федорович, 1982; Островский, Федорович, 1994; Островский, Федорович, 1996).
Необратимая агрегация фотопигмента родопсина в мембране, вызванная повреждающими дозами света, приводит к потере его нативных свойств и нормальной функциональной активности. Чувствительным тестом на нативность зрительного пигмента является его способность к регенерации при добавлении экзогенного 11-цис-ретиналя. В опытах in vitro на суспензии фоторецепторных мембран (Островский, Федорович, 1982), и в опытах in vivo при облучении глаза белой крысы (Капуста, Зак, Федорович и др., 1987) было показано, что способность родопсина к регенерации уменьшается, а электроретинограмма подавляется или исчезает вовсе. Ретиналь способен выступать фотосенсибилизатором (активатором) окисления и повреждения не только родопсина, но и других ретиналь связывающих и ретинальпереносящих белков. Показано, что он сенсибилизирует фотоокисление и повреждение двух ключевых белков зрительного цикла – АВСR, о чём было сказано выше, и водорастворимого межфоторецепторного ретиналь/ретинол-переносящего белка (IRBP). При действии света в полосе поглощения ретиналя, это в ближней ультрафиолетовой области (λ=380 нм), этот белок IRBP повреждается. Часть его цистеиновых и ароматических аминокислотных остатков окисляется и, что важно, при этом ухудшаются его функциональные свойства — это снижается способность связывать ретинол (Fedorovich, Semenova, Grant et al., 2000).
Крайне чувствителен к фотоповреждению, вызванному ретиналем как фотосенсибилизатором, оказался белок АBCR (Sun. Nathans, 2001), о котором подробно шла речь выше. Как и в случае родопсина, молекулярным механизмом повреждения АBCR является его агрегация (однако не за счет образования дисульфидных связей). Фотоокисление АBCR, обладающего, помимо способности связывать и переносить ретиналь также и АТФазной активностью, приводит к тому, что связанный с ним трансретиналь теряет способность стимулировать его АТФазную активность.
В результате ретиналь не «выбрасывается» из наружного сегмента в межклеточное пространство. Точнее, вызванный светом дефект ABCR (как и его наследственный дефект) ведет к накоплению в фоторецепторной мембране транс-ретиналя, образованию из него А2Е и избыточного количества липофусциновых гранул (Sun., Nathans, 2001) (рис. 6Б). Белок ABCR оказался более чувствительным к фотоокислению и повреждению, нежели другие белки мембраны фоторецепторов, и в том числе родопсин, α-субъединица трансдуцина, белок цГМФ-регулируемого ионного канала, а так-же периферические белки этой мембраны – родопсиновая киназа и арестин.
КислородПравить
Кислород является третьим необходимым участником реакции фотоокисления. Отмечено, что вдоль клетки фоторецептора сетчатки парциальное давление кислорода различно. В дистальной части наружного сегмента фоторецептора, расположенной ближе к пигментному эпителию и сосудистой оболочке, концентрация кислорода при сравнении с проксимальной (базальной) больше. Так, если в области верхушки наружного сегмента напряжение кислорода РO2 около 100 мм ртутного столба, что эквивалентно концентрации кислорода в артериальной крови, то в области проксимальной части (на границе с внутренним сегментом) — РO2 в темноте составляет всего лишь около 10 мм ртутного столба и порядка 30 мм — на свету. Разница может объясняться тем, что во внутреннем сегменте фоторецепторной клетки содержится большое скопление митохондрий, которые, как известно, являются основными потребителями кислорода. С различным парциальным давлением кислорода вдоль фоторецептора, скорее всего, связан градиент фотоповреждения ее наружного сегмента. Его дистальная часть содержит «старые», накопившие молекулярные дефекты мембранные диски, более чувствительные к повреждению. Свидетельством тому служит обнаруженный нами градиент уменьшения количества способных к титрованию SH-групп, с вектором от верхушки наружного сегмента («старые» диски) к его основанию (базальные «новые» диски) (Деревянченко, Федорович, Островский, 1985).
В опытах на крысах нами было показано, что избыток кислорода (гипероксия) и особенно гипербарическая оксигенация усугубляют повреждающее действие света на сетчатку, при чём существенно нарушается регенерация родопсина и намного снижается электрическая активность сетчатки (Капуста, Зак, Федорович и др., 1987).
Защита структур глаза от опасности фотоповрежденияПравить
Таким обоазом, сочетание света, кислорода, пигментов фотосенсибилизаторов и легко окисляющихся субстратов (липидов и белков) создает реальную угрозу для возникновения и развития в сетчатке и пигментном эпителии фотодеструктивных процессов. Этот парадокс зрения, когда свет выступает и носителем информации, и потенциально опасным повреждающим фактором, был решен в ходе эволюции созданием достаточно надежной многоуровневой системы защиты от опасности фотоповреждения.
Эта система включает:
- обновление фоторецепторных мембран,
- комплекс эндогенных антиоксидантов,
- механизм максимально быстрого удаления свободного ретиналя из зрительной клетки,
- систему оптических фильтров глаза, в которой ключевую роль играет хрусталик, желтеющий у приматов и человека с возрастом.
Нет сомнения, что нарушения в этой системе приводят к возрастанию риска светового повреждения сетчатки и пигментного эпителия.
Обновление мембран фоторецепторовПравить
Следовательно, первый и наиболее радикальный способ защиты — это постоянное обновление мембран фоторецепторов и всего наружного сегмента зрительной клетки (и палочки, и колбочки). Обновление позволяет избежать накопления в наружном сегменте молекулярных дефектов, благодаря чему молекулярная машинерия фоторецепторного механизма оста- ется эффективной на протяжении всей жизни организма. Процесс постоянного обновления наружного сегмента заключается в том, что в его базальной части постоянно образуются новые фоторецепторные мембраны (фоторецепторные диски), а в апикальной части пачки – «старых» дисков (верхушка наружного сегмента) обламываются (Young, 1974; а также см.: Островский, Донцов, 1984; Островский,Говардовский, 1992). Эти «об- ломки» затем эффективно фагоцитируются клетками пигментного эпителия. Процесс этот исключительно интенсивный: в течение суток около 100 дисков заново образуется и обламывается в каждой палочке (колбочке). Поскольку многочисленные отростки клетки пигментного эпителия окружают более десятка палочек, то за сутки каждая клетка «переваривает» около тридцати тысяч (!!) отработанных дисков. Клетка пигментного эпителия является одной из самых активных фагоцитирующих клеток в организме.
Процессу радикального обновления наружного сегмента фоторе- цепторной клетки, однако, свойственны издержки, связанные с возрастом. Здесь речь идет об избыточном накоплении в пигментном эпите- лии «пигмента старости» — липофусциновых гранул, являющихся, посуществу, «недопереваренными» обломками наружных сегментов — фагосомы и обладающих фототоксичностью (см.выше).
Липофусциновые гранулы могут занимать до 20% объема клетки.
АнтиоксидантыПравить
Следующая линия защиты от фотоповреждения — антиоксидантная. Речь идет о торможении процессов свободно-радикального фотосенсибилизированного окисления. В эту систему входят витамины Е (α-токоферол), С (аскорбиновая кислота), таурин и набор антиоксидантных ферментов (супероксиддисмутаза, пероксидаза, каталаза).
В дополнение к этому, в своё время было показано, что антиокисдантная система защиты усиливает экранирующие пигменты глаза – меланосомы (у позвоночных) и человека и оммохромы (у беспозвоночных)(Островский, Донцов, Сакина, 1980; Донцов, Островский, Сакина, 1980; Островский, Донцов, 1985; Островский, Федорович, Донцов, 1987; Ostrovsky, Sakina, Dontsov, 1987). Этим в значительной мере объясняется, почему альбиносы столь чувствительны к фотоповреждению. Интересно, что недостаток меланина у альбиносов частично компенсируется повышенным содержанием в их сетчатках α-токоферола (Ostrovsky, Sakina, Dontsov, 1987).
Удаления свободного полностью-транс ретиналя из зрительной клеткиПравить
О механизме максимально быстрого удаления свободного полно- стью-транс ретиналя из зрительной клетки в результате работы зрительного цикла, и в первую очередь одного из его ключевых белков – АТФ-зависимого кассетного переносчика ABCR, говорилось выше.
Оптическая система защитыПравить
И последнее, важная система защиты сетчатки и пигментного эпителия от фотоповреждения — оптическая. Оптическая система состоит из последовательности светофильтров — роговицы, хрусталика, экранирующих пигментов (меланосом и оммохромов) (подробнее см. Островский, Федорович, Донцов, 1987). Эти светофильтры отсекают от сетчатки и пигментного эпителия коротковолновое излучение – ультрафиолетовое (УФ) и частично синее-S. Rроме того, они уменьшают хроматическую аберрацию, улучшая, та- ким образом, контрастную чувствительность и остроту зрения.
Хрусталик как светофильтрПравить
Роль ключевого светофильтра играет хрусталик. У многих позво- ночных животных, обитающих в яркой световой среде, хрусталик от рождения интенсивно желтый, то есть эффективно отсекающий от сетчатки и пигментного эпителия УФ и синий свет. У человека хрусталик с возрастом желтеет, то есть в старческом (некатарактальном!) хрусталике перед сетчаткой как бы «вводится» дополнительный желтый светофильтр (Федорович, Зак, Островский, 1994) (рис. 9).
Где:
- 1 – новорожденные
- 2 – от 8 до 29 лет (10 хрусталиков)
- 3 – от 31 до 49 лет (25 хрусталиков)
- 4 – от 52 до 65 лет (14 хрусталиков)
- 5 – старше 70 лет (13 хрусталиков)
Это крайне важно для сетчатки и пигментного эпителия, поскольку возрастает эффективность их оптической защиты. У детей же и в молодом возрасте хрусталик, как правило, бесцветный и эффективно поглощает лишь ультрафиолетовое излучение. Следует отметить, что в младенческом возрасте хрусталик имеет «ультрафиолетовое окно», то есть пропус- кает к сетчатке определенную часть падающего на глаз УФ-света. Остается не ясным, является ли это «окно» лишь следствием несовершенства постнатального хрусталика (его белков кристаллинов) или оно необходимо для постнатального развития сетчатки и пигментного эпителия. Примерно к 15 годам УФ-«окно» исчезает и постепенно происходит пожелтение хрусталика, наиболее выраженное в старческом возрасте. Роль светофильтра — он способен выполнять устранения на ранних стадиях помутнения и катарактальный характер хрусталика (Розенблюм, Зак, Островский и др., 1995: Rosenblum, Zak, Оstrovsky et al., 2000). Ухудшая качество изображения на сетчатке такой желтоватый хрусталик эффективно задерживает коротковолновое излучение, способен до некоторой степени уменьшить хроматическую аберрацию и предотвратить вызванное светом усугубление некоторых форм дегенерации сетчатки.
Неблагоприятным следствием экстирпации хрусталика при ката- ракте является многократное повышение риска повреждения сетчатки УФ и синим светом. Исходя из этих представлений еще в середине 80-х годов был разработан и внедрен в клиническую практику «искусственный хрусталик» — новая окрашенная интраокулярная линза «Спектр» (Островский, Линник, 1987; Линник, Островский, Салиев и др., 1991; Линник, Островский, Зак и др., 1992). Подобно естественному хрусталику пожилого человека, эта линза полностью отсекает ультрафиолетовую и в значительной мере коротковолновую (фиолетово-синюю) часть видимого спектра. Важно отметить, что нормальное цветовосприятие пациента с имплантированным желтоватым хрусталиком не нарушается.
На рис. 10 сведены спектры поглощения основных эндогенных фотосенсибилизаторов — ретинола, ретиналя, липофусцина, а также спектры пропускания хрусталика глаза пожилого человека и линзы «Спектр». Видно, что и хрусталик глаза пожилого человека, и желтоватая линза в значительной мере отсекают коротковолновую часть видимого спектра, в которой поглощают опасные для сетчатки фотосенсибилизаторы. К сожалению, эффективных и безопасных лекарственных средств (антиоксидантов), способных предотвратить фотосенсибилизированное повреждение сетчатки и пигментного эпителия, пока не найдено.
ЗаключениеПравить
Таким образом, очевидно, что свет в зрении способен выступать не только как носитель зрительной информации, но и как фактор риска. В обоих случаях ключевой молекулой, поглощающей свет и запускающей как нормальный фоторецепторный процесс, так и процесс фотоповреждения, является ретиналь. Сразу следует подчеркнуть, что помимо ретиналя процесс фотоповреждения могут запускать в фоторецеторных клетках и клетках пигментного эпителия и другие эффективные фотосенсибилизаторы, в первую очередь продукты фотопревращения самого ретиналя (А2Е и эпокси-формы А2Е), липофусциновые гранулы, флавины и флавопротеины, а также при определённых условиях меланин и меланопсин.
Если триггером фоторецепторного процесса является фотохимическая реакция изомеризации хромофорной группы в молекуле зрительного пигмента – 11-цис-ретиналя, то в основе фотоповреждения лежат фотосенсибилизированные реакции свободно-радикального окисления.
Благодаря особенностям 11-цис-ретиналя как хромофора и его ближайшему белковому окружению молекула зрительного пигмента родопсина обладает уникальной фотохимической активностью: высоким квантовым выходом изомеризации (0, 65), который почти втрое превышает квантовый выход изомеризации ретиналя в растворе (0,22–0,24), и фантастически высокой скоростью фотоизомеризации, которая составляет 146 фемтосекунд, в то время как в растворе эта скорость – 1–2 пикосекунды (подробнее см. Liu and Colmenares, 2003). Молекулярная организация хромофорного центра родопсина и основы его высокой световой чувствительности в настоящее время подробно исследуются, в том числе методами молекулярного моделирования (Kholmurodov, Feldman, Ostrovsky, 2005 (in press)).
Ретиналь в полностью-транс форме, высвободившийся на последней стадии фотолиза родопсина, сам по себе и особенно продукты его превращения в фоторецепторных клетках и клетках пигментного эпителия – А2Е и эпокси-формы А2Е обладают фототоксичностью и представляют опасность как фотосенсибилизаторы процессов окисления. Причём если сам А2Е, будучи амфифильной молекулой, связан с мембраной, то гидрофильный эпокси-А2Е выходит в результате фотоокисления А2Е в цитоплазму и, будучи исключительно токсичным, представляет для клетки ещё большую опасность, повреждая, например, ДНК (Sparrow, Zhou, Cai, 2003). А2Е является основным, но далеко не единственным флуорофором липофусциновых гранул. Липофусциновые же гранулы, как рассматривалось выше, при освещении эффективно генерируют активные формы кислорода, включая синглетный кислород, суперокисные радикалы и гидроперекиси. Будучи токсичными, они инициируют прямо или опосредованно окисление липидов, белков, повреждение лизосом и в конечном счёте апоптоз. При обсуждении механизмов фотоповреждения сетчатки и пигментного эпителия особую важность представляет знание спектра действия фотосенсибилизированных реакций, вызывающих такое повреждение.
Совокупность полученных к настоящему времени данных свидетельствует о том, что максимум спектра действия этих реакций находится в синей области спектра. Особенно впечатляет почти полное совпадение спектров действия фотоповреждения пигментного эпителия глаза приматов в опытах Хэма (т.н. «blue light damage») (Ham et al., 1978) и потребление кислорода липофусциновыми гранулами при их освещении (Pawlak et al., 2002). В обоих случаях речь идёт о синей области спектра (см. рис.10). Поэтому исключительно велика вероятность того, что именно фототоксичность липофусциновых гранул ответственна в основном за повреждение клеток пигментного эпителия. Повреждение же этих клеток, как хорошо известно, ведёт затем к дегенерации и фоторецепторных клеток сетчатки. Липофусциновые гранулы или «пигмент старости» неумолимо накапливаются в клетках пигментного эпителия с возрастом и никуда не исчезают из этих клеток до конца жизни. Накоплено много данных о связи накопления этих, обладающих фототоксичностью гранул с усугублением развития дегенерации сетчатки, в том числе одной из её самых распространенных форм – старческой макулярной дегенерацией сетчатки. Показано, что накопление липофусциновых гранул хронологически совпадает с развитием этого заболевания и что область сетчатки, в которой накапливается наибольшее количество этих ярко флуоресцирующих гранул, наиболее чувствительна к дегенерации (Holz et al., 2001). Именно увеличивающаяся с возрастом опасность фотоповреждения сетчатки, которая коррелирует с накоплением в пигментном эпителии липофусциновых гранул и особенно с развитием старческой макулярной дегенерации сетчатки. Накоплено достаточно много эпидемиологических данных об усугубляющем действии света в патогенезе этого заболевания (Taylor etal., 1992; Cruickshanks et al., 1993; Klein et al., 1998; Wang et al., 2003; Tomany et al., 2004). И экспериментальные – исследования спектра действия фотоповреждения (см. выше), и клинические – использование интраокулярных линз (ИОЛ) без УФ-абсобера (Kraff et al., 1985), и эпидемиологические (см. выше) данные свидетельствуют о том, что не только ультрафиолетовый, но и в значительной мере синий свет ответственны за усугубляющее действие света в патогенезе дегенерации сетчатки. Отсюда следует, что использование светофильтров, полностью отсекающих от сетчатки ультрафиолетовую и частично синюю или сине-зелёную часть спектра, может оказать существенный защитный, профилактический эффект. Именно исходя из этого нами ещё в середине 80-х годов были предложены жёлтые ИОЛ, призванные защитить сетчатку и пигментный эпителий от опасности фотоповреждения как ультрафиолетовым, так и фио- летово-синим светом. Фактически спектры пропускания этих линз имитировали спектры пропускания естественного, некатарактального хрусталика глаза человека 45–50-летнего возраста (Островский, Линник, 1987; Линник и др., 1991; Линник и др., 1992). Кроме того, такие ИОЛ повышали за счёт уменьшения хроматической аберрации контрастную чувствительность скотопического (палочкового) и фотопического (колбочкового) зрения. Анализ результатов 17-летнего мониторинга по отдаленным клиническим последствиям имплантации наших интраокулярных линз «Спектр», проведенный за период с 1986 по 2003 годы в ГУ Межотраслевой научно-технический комплекс «Микрохирургия глаза» МЗ РФ, показал, что послеоперационные осложнения — отёк сетчатки в макулярной области (синдром Ирвит–Гасса), приводящий, как правило, к потере зрения оперированного глаза, наблюдались: в раннем периоде в 0,59% случаев по сравнению с 3%, а в позднем периоде в 0,06% случаев по сравнению с 1,5% (Островский и др., 2003; Линник и др., 2004). Наши многолетние усилия по созданию искусственного хрусталика с наиболее благоприятным, физиологически обоснованным спектром пропускания получили международное признание. Об этом, в частности, свидетельствует активное внедрение в последнее время в мировую офтальмологическую практику фирмой Alcon новых жёлтых ИОЛ (AcrySof® Natural IOL), спектр пропускания которых полностью соответствует спектру пропускания наших ИОЛ «Спектр».
Поиски оптимальных спектральных характеристик ИОЛ, а также спектральных очков и контактных линз, призванных максимально уменьшить риск фотоповреждения сетчатки и при этом наилучшим образом сохранить или даже улучшить качество зрительного восприятия, продолжаются (Rosenblum et al., 2000; Mainster et al., 2003). Совсем недавно, практически одновременно и независимо, появилось три статьи, в которых подробнейшим образом рассматривается перспективность применения светофильтров, в первую очередь окрашенных ИОЛ, отсекающих от сетчатки синюю или сине-зелёную часть видимого спектра и тем самым задерживающих развитие старческой макулярной дегенерации сетчатки (Meyers , et al. 2004, Nilson, 2004, Margrain et al. 2004). В ближайшие годы во многих офтальмологических центрах будут, по всей видимости, пред- приняты широкие клинические исследования эффективности применения такого рода светофильтров – ИОЛ и спектральных очков для замедления развития различных форм дегенерации сетчатки, в первую очередь старческой макулярной дегенерации сетчатки.
На основании выше данных исследований фотопигмента опсинов — родопсина можно также утверждать:
- фоторецептор палочка, содержащая пигмент родопсин, функционирует в условиях сумеречного и ночного срения и никакого отношения к дневному зрению не имеет. (Дополнительно см. Ретиномоторная реакция фоторецепторов);
- На основании данных молекулярного механизма фотоповреждений, механизма фототрансдукции, зрительного цикла рис.1,2,3,4,5,6, а также морфологии фоторецепторов палочек и колбочек и особенно мембран (размеры и форма) можно утверждать также, что фоторецепторы палочки и колбочки в цветном зрении совместно никак не могут одновременно работать, лишь в случае сумеречного освещения, когда имеются независимые излучатели света, цветовые лучи которых воспринимают колбочки, а остальные серые, не цветные, фоновые лучи воспринимают палочки.
- Ещё раз доказано, что лучи с длиной волны 498нм (граница сине-жёлтого диапазона), которые определяют переходную зону, как бы границу сумеречного и дневного освещения, когда палочки уступают место колбочкам при цветном зрении. При этом не случайно, что колбочки-S при наступлении дневного освещения (498нм) в системе трихроматизма ответственны за восприятие синих лучей в системе оппонентного отбора цветов цветного зрения в паре синий-зелёный спектры.
- Что касается вопроса способности любой колбочки фототрансдукцировать любой цветовой (RGB) сигнал, сфокусированной предметной точки на фокальную поверхность сетчатки и проведенный к мембране по нервным клеткам, усиленный в сотни раз (не цветовой), (рецепторный уровень) и возвращённый в зрительные отделы (нейронный уровень), где он окрашивается в нашем сознании, то здесь возможен вариант универсальности. (Внешняя мембрана сама изменчива и с большой скоростью способна менять фотопигменты опсины в зависимости от поступающего сигнала под контролем фоторецептора ipRGC и головного мозга. Но это вопрос открытый).
Принятые сокращенияПравить
- ABCR – АТФ-связывающий кассетный переносчик ретиналя, IRBP – межфоторецепторный ретинол-связывающий белок;
- A2E-PE – бис-ретинилиден-фосфатидилэтаноламин;
- A2E – бис-ретинилиден-этаноламин.
- Нумерованные ссылки типа[1],[2],[3],[4] и т.д. см. в Литература М. А. Островский ФОТОБИОЛОГИЧЕСКИЙ ПАРАДОКС ЗРЕНИЯ.
ЛитератураПравить
См. такжеПравить
ПримечанияПравить
- ↑ Sparrow Zhou, Ben-Shabat et al., 2002; Ben-Shabat, Itagaki,Jockusch et al., 2002
- ↑ http://www.library.biophys.msu.ru/PDF/3353.pdf М. А. Островский ФОТОБИОЛОГИЧЕСКИЙ ПАРАДОКС ЗРЕНИЯ
- ↑ http://webvision.med.utah.edu/
- ↑ http://www.library.biophys.msu.ru/PDF/3353.pdf М. А. Островский ФОТОБИОЛОГИЧЕСКИЙ ПАРАДОКС ЗРЕНИЯ
- ↑ http://www.eyenews.ru/pages.php?id=941&glaukoma=b1490a1da83cd41a44a522941aafd425 Л.А. Баранова, В.П. Емельянова, И.Д. Волотовский Молекулярные механизмы зрения (обзор литературы)
- ↑ http://www.library.biophys.msu.ru/PDF/3353.pdf М. А. Островский ФОТОБИОЛОГИЧЕСКИЙ ПАРАДОКС ЗРЕНИЯ
- ↑ http://www.library.biophys.msu.ru/PDF/3353.pdf М. А. Островский ФОТОБИОЛОГИЧЕСКИЙ ПАРАДОКС ЗРЕНИЯ
- ↑ http://www.library.biophys.msu.ru/PDF/3353.pdf М. А. Островский ФОТОБИОЛОГИЧЕСКИЙ ПАРАДОКС ЗРЕНИЯ
- ↑ http://www.library.biophys.msu.ru/PDF/3353.pdf М. А. Островский ФОТОБИОЛОГИЧЕСКИЙ ПАРАДОКС ЗРЕНИЯ
- перенаправление шаблон:цвета радуги